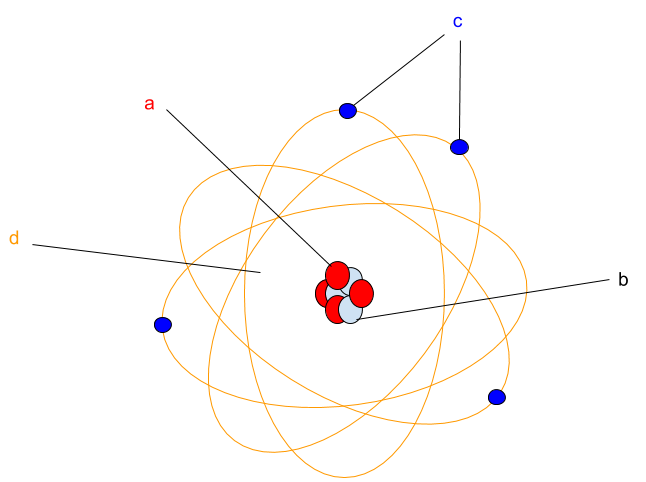
a) Nimeä atomin osat a-d. Kirjoita näkyviin myös osien a-c varaukset.(2p)
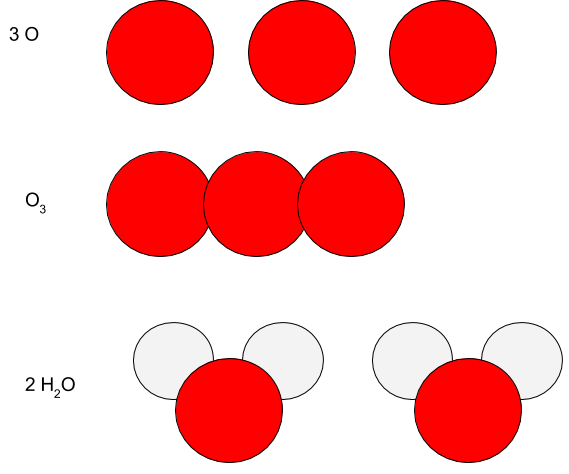
b) Mitä eroa on merkinnöillä $3 \ \text{O}$, $\text{O}_3$ ja 2 $\text{H}_2\text{O}$. Selitä sanallisesti ja piirrä kuva.(4p)
a) a = protoni, varaus: + $\color{Red}{(+\frac{1}{2}\text{ p})}$
b = neutroni, varaus: 0 $\color{Red}{(+\frac{1}{2}\text{ p})}$
c = elektroni, varaus: - $\color{Red}{(+\frac{1}{2}\text{ p})}$
d = elektronipilvi $\color{Red}{(+\frac{1}{2}\text{ p})}$
b) Merkintä 3 O tarkoittaa kolmea happiatomia.$\color{Red}{(+\frac{1}{2}\text{ p})}$
Merkintä $\text{O}_3$ tarkoittaa yhtä otsoni- eli $\text{O}_3$-molekyyliä. $\color{Red}{(+1\text{ p})}$
Merkintä 2 $\text{H}_2\text{O}$ tarkoittaa kahta vesi- eli $\text{H}_2\text{O}$-molekyyliä.$\color{Red}{(+1\text{ p})}$
 $\color{Red}{+\frac{1}{2}\text{ p / kuva}}$
$\color{Red}{+\frac{1}{2}\text{ p / kuva}}$
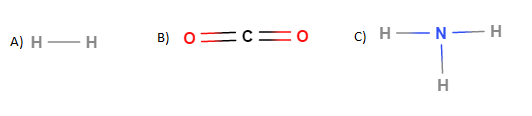
a) Kopioi alla oleva taulukko vihkoosi ja täydennä siihen yhdisteissä A, B ja C esiintyvien alkuaineiden elektronegatiivisuusarvot. (1p)
\(\begin{array}{|r|c|l|} \hline&\text{Alkuaine} & \text{Elektronegatiivisuus} \\ \hline \text{Yhdiste A} & \text{H} &\\ \hline \text{Yhdiste B} & C & \\ & O &\\ \hline \text{Yhdiste C} & N &\\ & H &\\ \hline \end{array}\)
b) Tarkastele yhdisteiden A, B ja C sidoksia. Ovatko sidokset poolisia? Perustele.(3p)
c) Ovatko molekyylit A, B ja C poolisia? Perustele.(2p)
a) Elektronegatiivisuusarvot:
Oikein täytetystä taulukosta $\color{Red}{(+1\text{ p})}$
b) Sidosten poolisuus
Yhdiste A
H - H -sidos: elektronegatiivisuusero \(=2,1-2,1=0\)$(+\frac{1}{2}$ p$)$
Koska aineiden välinen elektronegatiivisuus ero on 0, H-H -sidos on pooliton.$(+\frac{1}{2}$ p$)$
Yhdiste B
Yhdisteessä on kaksi kappaletta C=O -sidoksia.
C=O -sidos: elektronegatiivisuusero \(=3,5-2,5=1,0\)$(+\frac{1}{2}$ p$)$
Koska aineiden välinen elektronegatiivisuusero on positiivinen, C=O -sidos on poolinen.$(+\frac{1}{2}$ p$)$
Yhdiste C
Yhdisteessä on kolme kappaletta N-H -sidoksia.
N - H -sidos: elektronegatiivisuusero \(= 3,0-2,1=0,9\)$(+\frac{1}{2}$ p$)$
Koska aineiden välinen elektronegatiivisuusero on positiivinen, N - H -sidos on poolinen.$(+\frac{1}{2}$ p$)$
c) Molekyylin poolisuus
Yhdiste A
Koska molekyylissä on vain poolittomia sidoksia $(+\frac{1}{3}$ p$)$, on molekyylikin kokonaisuudessaan pooliton. $$(+\frac{1}{3}$ p$)$
Yhdiste B
Molekyylissä esiintyvät C=O-sidokset ovat poolisia, mutta molekyylin symmetrisyys kumoaa poolisuuden $(+\frac{1}{2}$ p$)$, joten molekyyli on pooliton.$(+\frac{1}{3}$ p$)$
Yhdiste C
Molekyylin kaikki sidokset ovat poolisia $(+\frac{1}{3}$ p$)$, eikä molekyyli ole symmetrinen, joten molekyyli on poolinen.$(+\frac{1}{3}$ p$)$
Kopioi taulukko vihkoosi ja merkitse ruksi sellaisten vuorovaikutusten kohdalle, joita ko. aineessa esiintyy.
\(\begin{array}{r|c|l} \hline & \text{Vetykaasu eli H}_2(g) &\text{Kiinteä ruokasuola NaCl(s)} & \text{Etanoli eli CH}_3\text{CH}_2\text{OH}(l) \\ \hline \text{kovalenttinen sidos} &&& \\ \hline \text{ionisidos} &&& \\ \hline \text{vetysidos} &&& \\ \hline \text{dipoli-dipolisidos} &&& \\ \hline \text{dispersiovoimat} &&& \\ \hline \end{array}\)
\(\begin{array}{l|c|c|c} \hline & \text{Vetykaasu eli H}_2(g) &\text{Kiinteä ruokasuola NaCl(s)} & \text{Etanoli eli CH}_3\text{CH}_2\text{OH}(l) \\ \hline \text{kovalenttinen sidos} &\text{x}&&\text{x} \\ \hline \text{ionisidos} &&\text{x}& \\ \hline \text{vetysidos} &&&\text{x} \\ \hline \text{dipoli-dipolisidos} &&& \\ \hline \text{dispersiovoimat} &\text{x}&&\text{x} \\ \hline \end{array}\)
(+1 p / oikea vastaus, $-\frac{1}{2}$ p / väärä vastaus)
Vetyjen välillä on kovalenttinen sidos. Koska H-H -sidos on pooliton, on vetykaasu pooliton yhdiste, joten molekyylien välillä esiintyy dispersiovoimia.
Kiinteä ruokasuola on ioniyhdiste, joten natrium- ja kloridi-ionien välille muodostuu ionisidoksia. Koska NaCl on ioniyhdiste, ei muodostu molekyylien välisiä vuorovaikutuksia.
Etanolimolekyylissä on kovalenttisia sidoksia. Etanolimolekyylien poolisten OH-ryhmien välille muodostuu vetysidoksia ja poolittomien hiiliketjujen välille muodostuu dispersiovoimia.
Tekemäsi itsearvion pohjalta tuloksesi prosentteina on:
